本帖最后由 活动小助手 于 2026-1-14 17:23 编辑
本文为《量子计算 + 生物制药产业与技术发展研究报告》的下半篇,点击链接阅读全文目录与上半篇文章:量子计算+生物制药产业与技术发展研究报告(上)。
《量子计算 + 生物制药产业与技术发展研究报告》针对量子计算 + 生物制药的产业发展、药物发现计算发展的变革、量子计算赋能药物发现的技术路线、应用场景案例等进行跟踪研判,同时对量子计算 + 生物制药发展趋势前景进行展望,供业界参考。
六、诺奖级理论驱动量子计算机的物理实现
6.1 从诺奖理论到量子计算硬件的物理实现
物理学的深邃思想,特别是关于如何利用物理系统本身特性来解决复杂计算问题的理念,正以前所未有的方式推动着计算技术的革命。无论是相干光量子计算还是超导量子计算,其目标都是将微观世界的量子规律转化为宏观可用的超级算力,从而突破经典计算的瓶颈。
“以物理系统寻找能量基态来实现计算” 这一思想,其价值和前瞻性在 2024 年得到了顶峰的印证。人工智能领域的先驱 John Hopfield 与 Geoffrey Hinton 因其开创的霍普菲尔德网络 (Hopfield Network) 和玻尔兹曼机而荣获诺贝尔物理学奖,其核心数学结构,正是脱胎于物理学的伊辛模型。这一里程碑式的认可,深刻揭示了物理学模型是现代 AI 算法的基石,当 AI 领域的突破回归到对伊辛模型的深刻洞察时,如何高效地在物理世界中实现并求解伊辛模型,便成为了推动下一代计算发展的关键。
6.1.1 相干光量子计算机的物理实现
在此背景下,量子退火机作为第一代专用硬件应运而生,其先驱 D-Wave 公司不仅将其开发使用量子退火用于优化,更展现了其作为玻尔兹曼采样器在训练量子玻尔兹曼机 (QBM) 上的潜力。近期成果尤为瞩目 2025 年 2 月,研究人员已成功在其 Pegasus 硬件上实现了包含 120 个可见单元和 120 个隐藏单元的大规模量子受限玻尔兹曼机 (QRBM),并将其作为强大的生成模型,在毫秒级时间内高效解决了 AI 领域的数据集不平衡问题,生成的合成数据质量显著优于传统方法。然而,量子退火机在面对生物制药等领域的复杂问题时,其稀疏的硬件连接拓扑和高昂的超低温运维成本仍构成了核心瓶颈。
而更进一步的实现方案,基于相干伊辛机 (Coherent Ising Machine, CIM) 的光量子计算应运而生。它继承了 “物理即计算” 的理念,但通过一个由光脉冲和光学反馈构成的网络来模拟伊辛系统。这种光学架构不仅能在室温下运行,更天然地支持灵活乃至全连接的耦合,直接克服了量子退火机的关键限制。更重要的是,CIM 不仅是高效的优化器,其物理过程更使其成为一个强大的硬件级玻尔兹曼采样器。它能绕过经典采样算法的瓶颈,为训练更强大的生成式 AI 模型 (如 QBM) 以发现新颖分子,提供了前所未有的高效工具。
6.1.2 超导量子计算机的物理实现
超导量子计算机是量子计算领域主要技术路径之一,其物理实现基于在极低温下呈现量子效应的超导电路 (即超导量子比特)。这些量子比特利用超导材料在接近绝对零度时表现出的零电阻和量子特性,并通过精密的微波脉冲进行操控与读取。
超导量子计算机的核心优势主要包括良好的工程可扩展性和在特定问题上展现出的指数级算力潜力。可扩展性得益于超导量子电路可采用成熟的半导体微纳加工工艺进行制备,使得集成大量量子比特更具可行性。而其算力潜力则源于量子比特的叠加和纠缠特性,例如,搭载 100 个量子比特的超导量子计算机,理论上能同时处理 2 的 100 次方个计算任务,从而在优化、模拟等复杂问题上具有经典计算机难以比拟的潜力。
然而,超导量子计算机的发展仍面临挑战。首先,其运行依赖极低温环境 (通常需低于零下 273 摄氏度),这需要复杂的稀释制冷系统。其次,量子比特的量子相干时间 (即保持量子态的时间) 仍有限,且易受环境噪声影响而发生退相干,同时量子门操作的精度和错误率也是当前需要攻克的关键技术难题。值得注意的是,通过技术手段 (例如在超导量子比特中引入特定无序) 有望在一定参数区间内提升量子相干时间。
尽管存在挑战,超导量子计算机目前仍是主流量子计算方案中工程化进展较快的路径之一,在量子计算技术发展中展现出广阔前景,已在金融、航空航天、生物医药、材料科学等领域展开了应用探索,展现出解决复杂问题的潜力。随着量子纠错等技术的进步,超导量子计算机有望在未来为复杂系统模拟、药物设计等提供更强大的计算支持。
研究者发现,以上诉求与物理系统自发趋向能量基态的过程与组合优化寻求目标函数最小值的本质具有一致性。伊辛模型正是连接这两个层次的核心数学框架 —— 它将优化问题转化为物理系统的能量最小化求解。
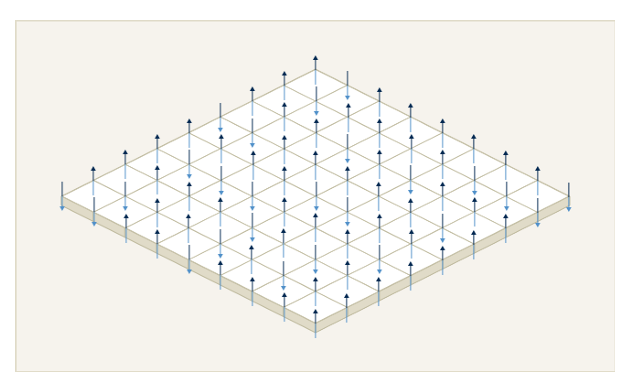
图 6-1 伊辛模型物理示意图
6.2 伊辛模型:药物发现优化的统一物理语言
为了高效求解这类问题,研究者们一直在探索如何普适性地描述并求解这类优化任务。一个令人振奋的发现是,某些源自物理学的模型,其描述物理系统如何自发演化并趋向能量最低的稳定状态的数学形式,与组合优化问题寻找最优解 (通常对应某种 “成本” 或 “目标函数” 的最小值) 的过程,展现出了深刻的内在一致性。“伊辛模型” 正是这样一个强大且极具代表性的物理模型和数学工具。
伊辛模型最初用于描述统计物理学中磁性物质的相变现象,它刻画了一个由大量相互作用的、只有两种状态 (例如 “自旋向上” 或 “自旋向下”) 的基本单元 (“自旋”) 组成的系统。该系统的总能量 (在物理学中称为哈密顿量 H) 取决于各个自旋的状态以及它们之间的相互作用强度,通常由以下公式给出:
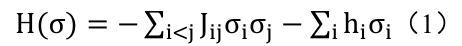
其中:
· σi代表第 i 个自旋变量 (在最简单的模型中,取值为+1或−1,分别代表两种相反的状态)
· Jij 是自旋𝑖和自旋𝑗之间的耦合 (相互作用) 强度
· hi 则是作用在自旋 i 上的外部 (偏置) 场强度
物理系统的一个基本法则是,它们总是会自发地趋向于使其总能量 (H(σ)) 最小化的状态,这个状态被称为系统的基态。
伊辛模型的价值体现在两个层面:其一是优化,物理系统总是会自发地趋向于使其总能量 H 最小化的状态,这个状态被称为系统的基态。通过巧妙的数学 “翻译”,大量的组合优化问题的目标函数可以被精确地表示成伊辛模型的能量函数形式,因此,寻找组合优化问题的最优解就等价于寻找相应伊辛模型的基态。
另一个价值体现则是采样,当系统处于一个有限的 “有效温度” 下,它会根据玻尔兹曼分布 (Boltzmann Distribution) 在不同的能量状态间进行探索,即某个状态出现的概率与其能量的负指数成正比。这恰好与一类重要的生成式 AI 模型 —— 玻尔兹曼机的数学原理完全一致。因此,一个能够模拟伊辛模型物理过程的设备,不仅是一个优化器,更是一个强大的玻尔兹曼采样器,这为构建量子玻尔兹曼机(QBM)提供了硬件基础。
6.3 QUBO 模型:优化问题的标准化 “语言”
为了更便于工程实现和在不同计算平台上进行标准化处理,伊辛模型通常会通过简单的线性变换,转化为另一种在优化领域和新兴计算 (包括量子计算和类量子计算) 中广泛应用的等价形式 —— 二次无约束二元优化 (QUBO, Quadratic Unconstrained Binary Optimization) 模型。
QUBO 问题的目标是找到一组二元决策变量xi(每个变量xi) 的取值为 0 或 1,代表两种选择,例如 “是 / 否”、“选中 / 未选中”),以最小化 (或最大化) 一个如下形式的二次目标函数:
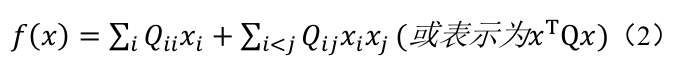
其中:
· x 是由二元变量 (x_{i}) 组成的列向量。
· Q 是一个对称的 N ∗N 维实数矩阵 (N 为变量个数),通常被称为 QUBO 矩阵。其对角线元素Qii对应于目标函数中与单个变量xi相关的线性权重 (或称偏置项),而非对角线元素 Qij则对应于不同变量 xi和xj之间相互作用 (或称耦合关系) 的二次项权重。
如前所述,伊辛模型和 QUBO 模型在数学本质上是等价的,它们之间可以通过简单的线性变量替换进行相互转换。这意味着,一个能够找到伊辛模型基态 (最低能量状态) 的物理系统或计算设备,也就能等效地求解对应的 QUBO 问题,反之亦然。QUBO 因其形式的简洁性和普适性,已成为将各类组合优化问题 “翻译” 给新兴优化硬件。
6.4 量子计算技术路径对比
6.4.1 相干光量子计算机的优势和挑战
理解了伊辛模型与 QUBO 模型如何为复杂优化问题提供标准化描述后,关键的挑战便在于如何高效地找到这些模型的基态 (即最优解)。玻色量子研发的相干伊辛机 (CIM) 是一种专为求解伊辛 / QUBO 这类组合优化问题而设计的专用计算硬件。其核心思想是通过精密设计的光学系统,构建一个能够直接模拟大规模伊辛系统动态演化的物理平台。
在这个平台中,伊辛模型中的 “自旋” 变量及其状态 (如 + 1 或 - 1,对应 QUBO 中的 0 或 1) 由光学系统中的特定物理量 (如光脉冲的相位或振幅) 来表示;自旋间的 “耦合强度” 和 “外场”(对应 QUBO 矩阵 Q 中的系数) 则通过精确调控光学元件之间的相互作用强度或对光学系统施加外部调制来实现。当具体的 QUBO 问题被编码到相干光量子计算机的参数设置中后,整个光学系统在驱动下会开始演化。凭借系统内在的非线性动力学特性以及可能的量子相干效应,系统能够自发地、并行地探索巨大的可能状态空间,并迅速趋向于一个整体能量最低的稳定状态。该稳定状态下光学系统各单元的物理量,就直接对应了原 QUBO 问题的最优解或高质量的近似解。
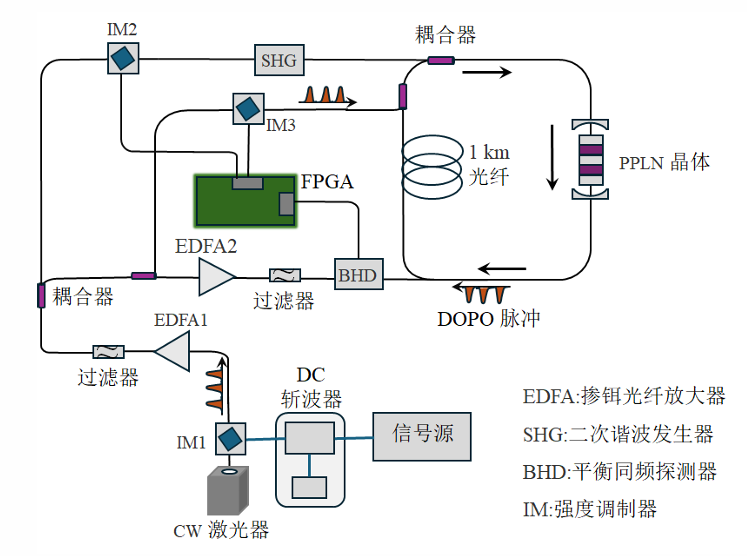
图 6-2 相干光量子计算机物理实现示意图
一种重要的物理实现是基于简并光学参量振荡器 (DOPO) 阵列构建的 CIM。其工作过程如下,超快激光器产生脉冲序列 (每个脉冲对应一个量子比特),经强度、相位等调校后,进入简并光学参量振荡过程,产生相应数量的 DOPO 脉冲。此时,腔中的循环脉冲相同且互不干扰,每个脉冲处于相位 0 和 π 的叠加态 (即量子态)。接着,通过分光器将部分光脉冲引导至电子学控制部分,利用零差测量 (BHD) 技术测量 OPO 脉冲的相位。外部输入的待求解 QUBO 问题的系数矩阵 (即 Q 矩阵) 与这些相位测量结果进行运算 (如矩阵乘法)。运算结果经适当延迟后,通过光学调制器将调控信号反馈注入光路系统,精确地实现脉冲间的耦合作用,从而构建起一个模拟目标伊辛模型的 N ∗N 耦合网络。这个过程不断循环迭代,系统状态持续演化。
最终,通过调节泵浦光的功率,当系统的光增益与耗散达到精确平衡时,整个 CIM 网络将经历光学参量振荡相变。在增益接近阈值且满足最小增益原理的条件下,系统倾向于在一个精确或近似的基态能量下稳定振荡,此时测量结果趋于稳定,标志着计算完成。进一步增加泵浦功率至阈值之上,可以继续抑制激发态的错误振荡模式,巩固基态解。区别于传统的 (模拟 / 数字) 退火搜索算法和基于量子隧穿的量子退火算法,CIM 的核心机制在于利用最小增益原理:在光学参量振荡器 (OPO) 增益小于耗散的情况下,通过逐步增大泵浦功率,系统被驱动至能量耗散最小的状态,即对应伊辛模型的基态。
玻色量子所采用的相干光量子计算机方案,其应对生物制药优化挑战的有效性与潜力,可以以几个关键层面进行综合考量:
1.专用性带来的效率与近场优势:作为专用量子计算机,CIM 聚焦于求解组合优化问题这一核心任务,规避了通用量子计算机面临的短期工程难题,因此更有可能在近期实现实际应用价值。
2.与生物制药问题的直接映射和高适应性:生物制药领域的诸多优化难题与 QUBO / 伊辛模型的天然数学契合性,使得相干光量子计算机可以直接 “理解” 并高效处理这些问题。特别是相干光量子计算机,其基于光学的互连特性,在理论上更容易实现灵活甚至全连接的有效比特间耦合,这对于直接映射结构复杂、变量间存在密集耦合关系的生物制药 QUBO 问题 (例如蛋白质残基相互作用网络) 可能更具优势,从而减少了问题编码转换的开销和潜在的精度损失。
3.光量子路径的独特硬件优势:相干光量子计算机技术路径,因其在室温或近室温运行的潜力、光子的高速低损耗传输特性、以及与成熟的光通信和集成光路 (PIC) 技术的良好兼容性等方面展现出的独特前景,使其在系统稳定性、未来可扩展性 (易于芯片化和规模化)、整体能耗以及部署便捷性上,相较于需要极端低温环境的超导量子计算方案,可能更易于在生物制药企业或研究机构的 IT 环境中实现规模化落地和推广,并具有更优的成本效益。
4.解决 “组合爆炸” 的潜力与求解质量:CIM 通过其物理并行性和独特的全局搜索机制,为高效求解那些具有 “组合爆炸” 特性、令经典计算机束手无策的 NP 难或 NP 硬优化问题,提供了前所未有的潜力。其独特的非线性动力学求解过程,在某些情况下可能比量子退火更快地收敛到高质量解,或更有效地避免陷入局部最优。
6.4.2 超导量子计算机的优势和挑战
超导量子计算机作为当前量子计算领域商业化进展最快、最受关注的技术路径之一,在生物制药领域展现出显著的应用潜力。其发展态势迅猛,尤其在处理复杂的生物分子模拟和药物设计任务时,展现出巨大的优势。
首先,超导量子计算机能够精确模拟生物分子的量子力学行为,这对于理解生物分子的结构和功能至关重要。例如,在蛋白质折叠路径预测中,超导量子计算机能够通过高精度的量子模拟,提供更准确的构象转移路径分布。这可以为药物设计提供重要的理论支持,帮助研究人员更好地理解药物作用机制。此外,在处理高维生物医学数据 (如医疗影像、基因组学数据) 时,超导量子计算机在训练量子机器学习模型方面潜力巨大。其并行处理能力有望提升模型性能与泛化能力。例如,在乳腺癌钼靶检测中的应用中,就展示了超导量子计算机在处理高维医学影像数据时应对假阳性率高和效率低问题的潜力。目前,多家国际制药巨头也在探索利用量子计算加速 mRNA 药物研发。
然而,超导量子计算机也面临着一系列的挑战。
1.低温运行环境:超导量子计算机的运行需要极低的温度环境,通常在接近绝对零度的条件下。这需要复杂的制冷系统来维持,增加了系统的复杂性和成本。这种低温环境限制了超导量子计算机在普通实验室和工业环境中的广泛应用,需要专门的设施和技术支持。
2.量子比特的退相干和错误率:量子比特的退相干和量子门操作的错误率较高,这需要更复杂的量子纠错技术来保证计算的准确性。退相干是指量子比特由于与环境的相互作用而失去量子态的现象,这会严重影响量子计算的精度和可靠性。量子门操作的错误率则直接影响量子计算的效率和准确性。这些技术挑战需要通过不断的研究和技术创新来解决。
3.硬件成本和专业要求:超导量子计算机的硬件成本较高,且对操作和维护人员的专业要求也较高。这限制了其在生物制药领域的广泛应用,需要专业的技术人员进行操作和维护。此外,超导量子计算机的开发和应用需要跨学科的合作,涉及物理学、计算机科学、化学和生物学等多个领域。
4.技术成熟度和可靠性:尽管超导量子计算机在理论和实验上取得了显著进展,但其技术成熟度和可靠性仍需进一步提高。目前,超导量子计算机的性能和稳定性仍受到多种因素的限制,需要在实际应用中不断优化和改进。
尽管面临这些挑战,超导量子计算机在生物制药领域的应用前景依然广阔。随着技术的不断进步,超导量子计算机的性能将不断提升,其在生物制药领域的应用将更加成熟和可靠。未来的研究方向包括提高量子比特的相干时间、降低量子门操作的错误率、优化量子比特的耦合和控制技术,以及开发更高效的量子纠错技术。这些技术的进步将使超导量子计算机在生物制药领域的应用更加广泛,为新药研发带来革命性的变革,加速个性化医疗和精准医疗的发展。
七、量子计算 + 生物制药关键应用场景解析
在生物制药领域,从靶点发现到先导化合物的筛选与优化,贯穿着两大根本性的计算挑战:一是在天文学数字般的化学分子空间 (预估超过 10^60 量级) 中进行高效搜索的 “组合爆炸” 难题;二是如何从高维、高噪声的多组学数据中精确解析复杂的生命调控网络。这些挑战的本质,大多可以归结为大规模的组合优化问题或对复杂概率分布的高效采样问题,这恰恰是经典计算面临的理论瓶颈。
相干光量子计算机通过其独特的物理机制,为这两类难题提供了全新的解决思路。它不仅能作为专用优化器,高效求解被转化为 QUBO / 伊辛模型的组合优化问题,还能作为硬件级的玻尔兹曼采样器,探索经典算法难以触及的概率空间。相干光量子计算机赋能药物发现的核心应用路径也清晰地分为三类:一是利用其组合优化能力加速药物筛选与设计;二是利用其硬件级玻尔兹曼采样能力构建量子增强的机器学习模型,以探索化学与构象空间;三是基于量子计算的特性重构生成式 AI 模型,实现更高效的分子从头设计与优化。
7.1 发挥组合优化天然优势 —— 加速药物筛选与设计
7.1.1 基于结构的虚拟筛选 - 分子对接
分子对接 (Molecular docking) 是基于配体 - 受体识别的锁钥模型提出的技术方法,通过计算配体 - 受体之间的空间互补状态以及能量匹配来寻找复合物模式,是基于结构的虚拟筛选中的重要技术手段。经典的分子对接主要分对接构象采样和打分两步,其中对接构象采样是一个 NP-hard 问题,巨大的对接构象搜索空间使得经典计算在采样时间和准确率上难以兼顾,严重限制了活性分子筛选效率。2023 年,玻色量子与上海交通大学联合研究团队提出了网格点匹配 (Grid Point Matching,GPM) 和原子特征匹配 (Feature Atom Matching,FAM) 算法模型,通过将配体与靶蛋白的对接问题转换为配体原子和对接格点的匹配问题,并添加位置约束和配体空间形状约束,构建得到以下伊辛模型:
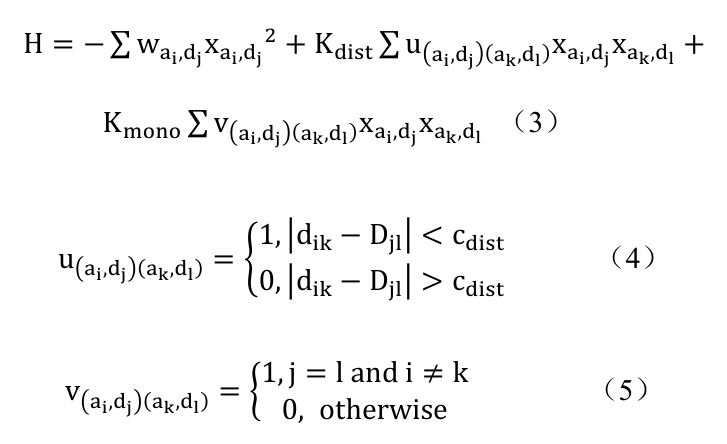
其中,wai, dj为原子 ai放置在格点dj上的适配度,Kdist、 Kmono、cdist为模型三个可调参数。通过 CIM 求解上述伊辛模型可得到配体对接构象。
研究团队在 CASF-2016 标准测试集对基于 CIM 的对接方法和商业化对接工具 Glide SP 进行了表现对比 (见图 7-1)。结果显示,GPM 与商业化软件具有相当的采样能力,但在速度上,基于 CIM 的求解速度比经典算法快至少三个数量级,该算法显著提升了对接效率,有望实现高精度的超高通量筛选。
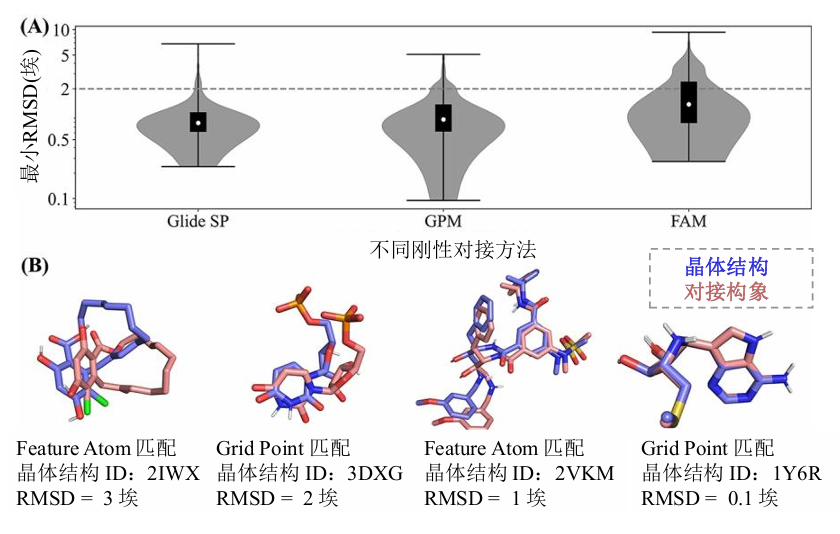
图 7-1 GPM 和 FAM 在 CASF-2016 数据集上的采样表现比较
图 7-1 (A) 为 Glide SP、GPM 和 FAM 采样构象中最小 RMSD (mRMSD) 的分布,灰色虚线表示高质量对接阈值 ((<2 \AA)) 。图 7-2 (B) 为采样的对接构象 (红色) 与晶体结构 (蓝色) 中的构象比较示例。
7.1.2 基于配体的虚拟筛选 - 分子相似性计算
分子相似性 (molecular similarity) 是化学分子间的重要比较信息,相似性原理指出,总体相似的分子应具有相似的生物活性,分子相似性应用广泛,包括靶标预测、结合姿态预测、毒性预测、挖掘靶标与药物数据关联、虚拟筛选等。现有方法主要利用分子指纹的表征方式进行相似性计算,但其只考虑二维的原子及官能团排布,忽略了分子中不同原子的空间位置关系,这些构效关系对于分子与蛋白的结合至关重要。Maritza Hernandez 等提出了基于图论方法解决分子相似性计算中的原子匹配问题,如图 7-2 所示,通过构建冲突图 conflict graph 并添加相关约束构建 QUBO/Ising 模型,并使用 QA 在小规模上数据上进行了验证。上述模型在 CIM 上可同样求解,在 CIM 大比特数以及全连接特性下,能解决更复杂的分子匹配问题。
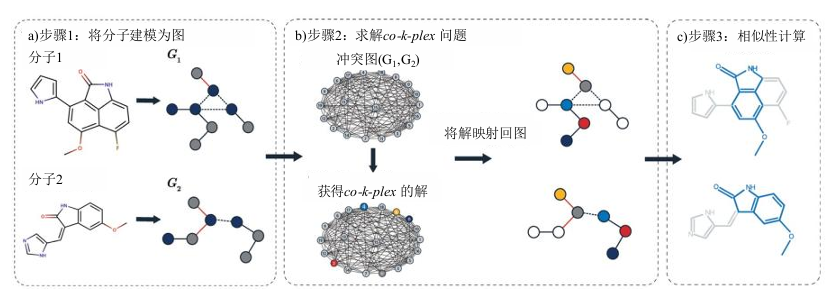
图 7-2 基于图的分子相似性计算 (Graph-based Molec lar Si ilari y, GMS) 算法示意图
7.2 构建量子增强机器学习模型 —— 探索化学与构象空间
7.2.1 基于 CIM 的玻尔兹曼采样技术原理
玻尔兹曼采样 (Boltzmann sampling) 是一种基于玻尔兹曼分布 (Boltzmann distribution) 的概率采样方法,主要应用于统计物理学、机器学习和优化问题中。伊辛模型中哈密顿量描述了各个自旋变量两两互作和自身的能量状态,因此在温度确定下,CIM 基于伊辛模型的采样结果应该符合玻尔兹曼分布:p (state) ∝ (e^{-E / k_{B} T}) 。2016 年,Hiromasa Sakaguchi 等将 CIM 首次应用于基于结构虚拟筛选的分子优化场景中,通过建立配体分子片段组合以及和靶点的结合能量函数计算模型,实现了基于 CIM 玻尔兹曼采样的活性片段筛选优化,证明了基于 DOPO 计算的 CIM 在以伊辛模型为基础的玻尔兹曼采样能力。这里,基于 CIM 的玻尔兹曼采样能力,并结合已有研究列举了两个重要的应用方向。
7.2.2 基于 CIM 玻尔兹曼采样应用 1: 小分子构型采样
分子构型采样是 CIM 基于玻尔兹曼采样的应用拓展方向之一。分子构型采样是计算化学和分子模拟中的核心任务,旨在探索分子的可能空间构型如键长、键角、二面角等,用于研究分子稳定性、反应路径、自由能景观、晶型预测等。主要方法包括基于蒙特卡洛采样的构象随机生成和基于分子动力学 (Molecular dynamics, MD) 的数值求解牛顿运动方程来模拟原子的运动轨迹。基于蒙特卡洛的分子构型采样能壁跨越困难,往往容易陷入局部最优。另外,随机变化的方向和幅度难以预判,因而很难获得下一个重要构象,对于最低能量构象难以在短时间内采样得到;基于分子动力学的运动轨迹模拟需要建立在有效的力场体系下,经典力学体系在计算速度上较快,但精度欠佳,基于量子力学的体系精度尚可,但计算量巨大,只能在局部区域实现量子级模拟,这些方法的局限性使得高精度的构型采样在现有计算体系下很难满足。Kevin Mato 等通过将分子键角、二面角等采样参数离散化并以分子展开距离目标函数构建 QUBO/Ising 模型实现了分子折叠预测,受此启发,可通过对不同键角和二面角进行离散化并构建整体能量函数,借助 CIM 可实现基于玻尔兹曼分布的分子构型采样。
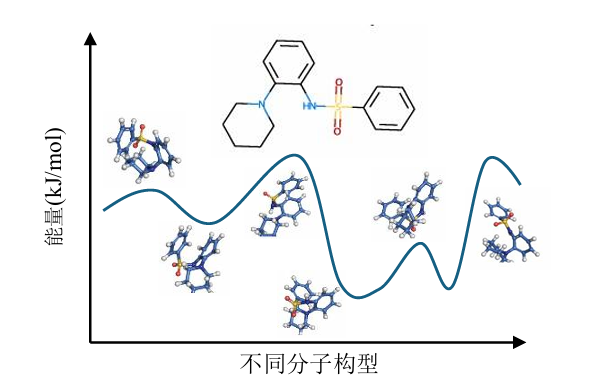
图 7-3 不同分子构型的能量分布
7.2.3 基于 CIM 玻尔兹曼采样应用 2: 蛋白折叠路径预测
CIM 基于玻尔兹曼采样的另一个重要的可应用方向为蛋白质折叠预测,自然状态下,线性氨基酸链通过一系列物理化学作用自发形成特定三维结构,该折叠过程决定了蛋白质的功能,若折叠错误可能导致严重疾病,如阿尔茨海默病、帕金森病等。折叠过程遵循热力学第二定律,由自由能最小化原则主导。多肽链通过疏水作用、氢键、范德华力等非共价相互作用,从高能无序态 (变性态) 转变为低能有序态 (天然态)。对于生物大分子,先进的基于人工智能的方法如 AlphaFold、RoseTTAFold 等能预测较高精度的晶体结构,但此结构是大分子固定状态时的空间结构信息,无法描述其具体的折叠动态过程。探究此过程一般借助经典计算下的 MD 模拟方法,然而,MD 在经典力学力场下模拟全原子运动轨迹也需要消耗巨大算力,更精确的量子力学力场体系则只能模拟局部原子的运动信息。Danial Ghamari 等构建了一个基于 QA 和经典计算的混合框架,实现了蛋白质等大分子的稀有构象转变路径的高效采样,克服了传统 MD 模拟在时间尺度上的局限性。该框架首先基于 Intrinsic Map Dynamics (iMapD) 建立了蛋白构象空间,并将构象空间离散化为节点 (代表构象区域) 和边 (代表区域间转移权重) 的图,接下来基于 Langevin 动力学推导出粗粒度有效作用量 (coarse-grained effective action) 作为权重,从而将路径采样问题转换为基于哈密顿量的连通图采样,其中目标哈密顿量,为约束路径拓扑,为路径统计权重。上述模型可转换为 CIM 适配的伊辛模型,并基于能量函数进行玻尔兹曼采样得到大分子的构象转移路径分布,基于大比特数的 CIM 能实现更多构象的转移路径,得到较为连续的构象转移过程模拟。
7.2.4 基于超导量子计算机的增强机器学习模型
超导量子计算机利用其独特的量子并行等特性,在增强经典机器学习模型方面展现出巨大潜力。其核心价值在于,能够借助量子神经网络、量子嵌入图网络等新型算法架构,高效处理经典计算机难以应对的高维数据优化与特征提取问题。
在医疗影像分析领域,乳腺钼靶检测的准确性和效率对乳腺癌早期筛查至关重要。国内研究机构与量子计算团队合作,开发了基于超导量子计算硬件的乳腺钼靶检测原型应用。该应用采用了一种混合经典 - 量子图像算法:经典神经网络负责从钼靶图像中提取特征并进行数据预处理,量子神经网络则在此基础上对病灶的良恶性等关键指标进行分类。这种架构结合了二者优势,在处理高维医学影像数据时展现出潜力,有望助力解决传统检测中假阳性率高和效率低的问题,从而辅助医生提升筛查精度与效率。
在药物发现领域,精准预测分子性质是快速筛选候选药物的关键。国内高校与研究团队合作,在超导量子计算硬件上成功完成了基于量子边编码技术的药物分子性质预测验证。该技术的核心是创新地设计了量子嵌入图神经网络架构。传统量子化图神经网络方法通常侧重于处理分子原子 (“点”),却难以有效编码化学键 (“边”) 的信息。新架构通过量子边编码技术,在量子层面实现了对原子和化学键的同步处理,能够更清晰地捕捉分子内部的相互作用。实验结果表明,该技术能显著提升对关键药物性质的预测准确率。例如,在针对阿尔茨海默病药物的某项预测任务中,其准确率相较经典方法的 64% 提升至 70%。
7.3 重构 AI 模型 —— 实现分子从头设计与优化
7.3.1 基于 Ising/QUBO 模型的分子从头设计和优化
相较于从已有分子库中进行活性分子筛选,分子从头设计是另一种新兴成药策略。分子从头设计指不依赖已知分子模板,而通过算法生成全新分子结构。优化过程则需调整分子特性如生物活性、成药性等,可分为基于原子、基于片段、基于反应的分子从头设计。Akshay Ajageka 构建了一个基于深度学习和 QUBO/Ising 的从头设计优化框架,该框架包含一个基于分子表征预测化学性质的回归模型,同时还包含一个基于目标化学性质进行序列优化的 QUBO/Ising 模型。其优化目标是不断迭代得到一个确定分子不同位置原子组成的邻接矩阵 (A_{ij}) 使得其预测的化学性质逼近目标化学性质。该模型基于 QA 进行了小规模验证,借助 CIM 的大规模 COP 求解能力,可以较原工作设计得到更大的分子以及实现多目标优化。
7.3.2 伊辛机增强的 D-VAE 实现分子性质优化
变分自编码器 (Variational Autoencoder,VAE) 是目前流行的一种生成模型,其核心思想是通过编码器将输入数据映射到潜在空间,然后通过解码器从潜在空间生成数据。2023 年,Tsud 研究团队将相干伊辛计算应用于自动分子设计优化上,研究团队构建了基于图的离散变分自编码器 (D-VAE),将分子结构编码为 {0, 1} 的离散潜在向量,同时训练因子分解机 (Factorization Machine) 作为性质预测的代理模型;使用伊辛机在离散潜在空间中搜索得到更优的隐变量表示,通过 decoder 可以解码得到真实分子图或者序列信息。该工作说明离散的隐变量空间可能更符合化学分子的真实能量分布,在该隐空间采样可以生成得到性质更优、多样性更好的分子。
7.3.3 超导量子计算在分子设计中的应用
超导量子计算在分子设计领域同样展现出独特潜力,其核心优势在于能够通过量子并行性高效探索巨大的分子构象空间,从而加速最优药物分子的发现过程。2023 年发表在《PLOS Computational Biology》上的一项开创性研究 (Khatami et al.,19 (4): e1011033) 首次提出了基于超导量子硬件的量子蛋白质设计方法,为分子设计提供了新的技术路径。
该研究以重要的药物靶点 ——FK506 结合蛋白 (FKBP) 为模型系统,在 IBM 的 27 量子比特超导处理器上进行了实验验证。研究人员创新性地将蛋白质设计问题转化为可处理的优化模型,通过量子门电路直接构建哈密顿量来模拟氨基酸间的相互作用能量。采用量子近似优化算法在超导芯片上生成初始候选解,再结合经典计算机进行分子动力学验证,形成高效的量子 - 经典混合优化流程。
实验取得了显著成果,在真实量子硬件上成功实现了对 12 个关键氨基酸位点的并行优化,量子电路深度达到 40 层且保真度高达 94%。与经典模拟退火算法相比,量子方案将最优结构搜索速度提升了 100 倍,并且所得蛋白质构象的自由能降低了 15%。该方法成功筛选出具有更高靶点亲和力的突变体,例如将第 36 位苯丙氨酸替换为酪氨酸的变异体,为开发新型免疫抑制剂提供了高质量的候选分子。
这项研究验证了超导量子计算在分子设计中的两大核心价值:一方面,量子算法能够通过量子隧穿效应避免经典优化方法容易陷入局部最优的问题,实现更高效的全局搜索;另一方面,超导量子芯片与半导体工艺兼容的特性为其未来处理更复杂的蛋白质设计问题 (如含有 100 个以上氨基酸的蛋白质) 提供了可扩展的技术基础。随着超导量子处理器性能的持续提升,这项技术有望将传统需要数月的分子设计周期大幅缩短,为药物研发带来革命性的进步。
7.4 新型量电融合计算平台
新型量电融合计算服务平台 (以下简称 “平台”) 是量子计算与生物制药深度融合的创新成果,旨在通过整合量子计算和经典计算资源,突破传统计算瓶颈,为生物制药研发提供高效、精确的解决方案。平台为量电融合应用提供运行底座,通过统一的服务入口,平台实现量电融合计算任务的智能拆解、编排、调度与执行,帮助用户简化任务管理、优化资源利用。
平台全面支持生物制药研发流程,从靶点发现到药物设计,再到机理验证,提供一站式解决方案。在靶点发现阶段,量子计算的强大采样能力可快速筛选潜在药物靶点;在药物设计阶段,量子计算探索化学空间,生成特定性质的分子结构,经典计算评估其成药性和生物活性;在机理验证阶段,平台结合量子计算的高精度模拟和经典计算的数据分析,深入探究药物作用机制,为临床前研究提供理论基础。
平台的技术优势在于突破传统计算瓶颈,高效求解生物制药复杂问题。平台可智能解析量电融合计算任务并高效分配至光量子计算机、超导量子计算机、经典计算机、量子计算模拟器等异构计算资源,支持用户便捷提交任务、动态优化资源分配,实时监控混合任务执行状态,提升计算效率。量子计算在组合优化和概率分布采样问题上具有显著速度和精度优势,经典计算的稳定性则确保平台在实际应用中的可靠性和可扩展性。平台还具备高度灵活性和可定制性,可根据不同研发需求进行个性化配置。平台适配多种异构硬件架构,包括经典电子计算、多类型量子计算机及混合计算环境,可满足不同场景需求。
平台大幅降低了量电融合应用开发门槛,随着量子计算技术进步和平台功能完善,该平台有望在生物制药领域发挥更大作用,为新药研发带来变革,加速个性化医疗和精准医疗发展。新型量电融合计算服务平台为生物制药行业提供强大的计算服务底座,整合量子计算和经典计算优势,解决生物制药复杂计算问题,为新药研发和个性化医疗带来新可能。
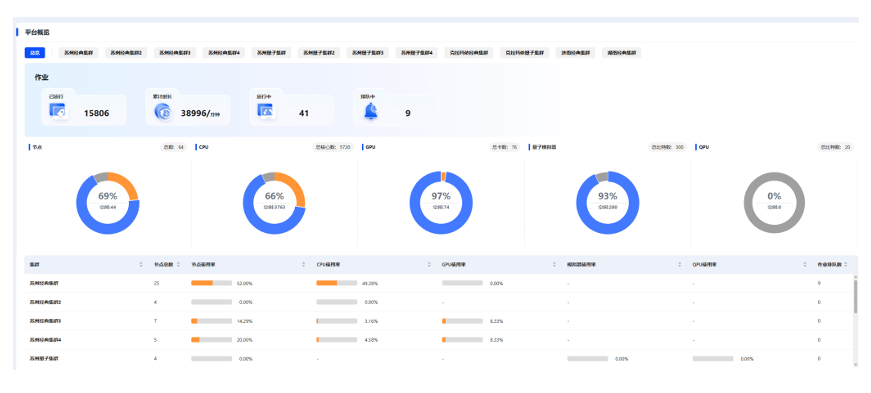
图 7-4 新型量电融合计算服务平台异构资源总览
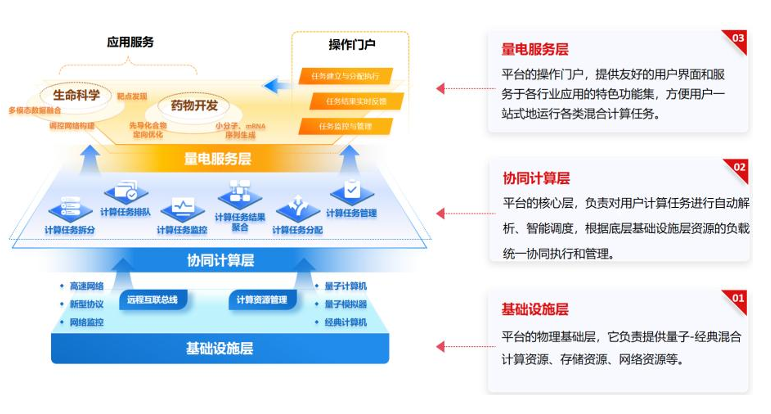
图 7-5 新型量电融合计算服务平台
八、量子计算重塑生物制药未来
我们正站在一个计算范式变革的前夜。量子计算技术,特别是相干光量子计算与超导量子计算这两种主流路径,正从实验室走向实际应用,为解决生物制药领域的复杂计算难题带来前所未有的机遇。尽管技术路径不同,但它们在发展初期都将通过 “量子 - 经典” 混合计算模式,作为经典算力的加速器,在药物研发的特定环节寻求突破。其长期愿景均指向对复杂生物系统的高精度模拟,以期攻克 “不可成药” 靶点,并加速精准医疗的到来。
8.1 相干光量子计算的未来展望
相干光量子计算机,其核心优势在于专攻特定类型的组合优化问题。这类问题在药物研发中广泛存在,例如分子对接构象搜索、蛋白质折叠路径优化等。
在未来几年,它有望作为高效的专用协处理器,无缝嵌入现有的高性能计算集群。通过快速从海量可能构象中锁定能量最优或最稳定的少数几种,它能极大地压缩虚拟筛选和蛋白质设计所需的计算时间,充当研发流程中的 “优化加速器”。随着规模扩大,它有望解决更复杂的生物网络优化问题,例如在合成生物学中优化代谢通路,或在多靶点药物设计中寻找全局最优解。
8.2 超导量子计算的未来展望
超导量子计算是目前最主流的通用量子计算路径之一,其目标是构建可编程的量子处理器。其核心潜力在于直接模拟分子的量子力学行为。
随着比特数量与质量的提升,并通过云平台开放接入,超导量子计算机将在分子性质预测和化学反应模拟等任务中展现潜力。例如,基于超导量子芯片的量子嵌入图神经网络,已实现在真实硬件上对药物分子性质的更高精度预测。其终极目标是构建容错通用量子计算机,实现对任意生物分子体系的高精度全量子模拟。
尽管目前仍面临量子纠错、比特稳定性等核心挑战,且实现具备基本功能的通用机可能仍需 10 年以上,但其强劲的发展势头使其成为最具颠覆性潜力的技术路线。
综上所述,对于生物制药行业的每一位参与者而言,现在正是拥抱量子,共塑未来的关键窗口期。在可预见的未来几年内,不论是相干光量子计算机还是超导量子计算机,其的短期价值在于作为经典计算的有力补充和高效加速器,在药物研发流程中的特定优化环节率先实现应用突破。通过构建 “量子 - 经典” 混合计算流程,聚焦于分子对接、虚拟筛选、蛋白质设计等多类计算密集型优化问题,有望显著提升计算效率,缩短研发时间。
而其长期愿景则更为宏大。随着量子硬件的不断成熟,量子计算有望在更深层次、更广范围赋能生物制药行业。凭借对分子量子力学行为的精确模拟能力,未来的量子计算机可能实现真正意义上的高精度从头药物设计,攻克 “不可成药” 靶点,并通过高效整合个体多组学数据,加速个性化与精准医疗的到来。

微信扫码直接下载研报
—— END —— | 


























