本帖最后由 Jack小新 于 2026-1-11 23:19 编辑
印度贾米亚・米利亚・伊斯兰 ia 大学团队在 International Journal on Smart & Sustainable Intelligent Computing 2025 年 6 期发表系统综述,全面探讨了量子机器学习(QML)在药物发现领域的应用价值。该综述梳理了 QML 融合量子计算与机器学习的核心机制,详细分析了其在分子性质预测、药物 - 靶点相互作用预测、全新分子生成三大核心场景的应用现状。文章对比了 QML 与经典机器学习的技术差异,指出 QML 在并行处理、量子模拟适配性、低数据依赖等方面的独特优势,同时剖析了当前面临的硬件限制、量子噪声、数据嵌入等挑战,并展望了算法优化、跨学科合作、开源框架建设等未来方向,为量子计算与化学、生物学的跨学科研究提供了重要参考,推动药物研发向高效、精准方向转型。

传统药物研发是一场漫长且昂贵的 “持久战”—— 从分子筛选到临床试验,往往需要耗费数年时间和数亿美元成本,核心瓶颈在于分子的量子特性与复杂相互作用难以被经典计算机精准模拟。随着量子计算与机器学习的深度融合,量子机器学习(QML)应运而生,为破解这一困境提供了全新思路。2025 年,印度贾米亚・米利亚・伊斯兰 ia 大学团队在《International Journal on Smart & Sustainable Intelligent Computing》发表系统综述,全面梳理了 QML 在药物发现领域的应用现状、核心优势、挑战与未来方向,为跨学科研究搭建了重要桥梁。
一、经典机器学习的研发困境,QML 如何破局?
在药物研发的核心环节中,经典机器学习(CML)虽已广泛应用,但始终难以突破自身局限,而 QML 的独特机制恰好精准适配这些痛点:
1.1 经典机器学习的三大局限
经典机器学习依赖经典计算机的二进制比特处理信息,在面对分子系统时显得力不从心:
无法捕捉量子本质:分子、原子的相互作用本质是量子现象,涉及电子跃迁、量子纠缠等特性,经典模型只能通过近似算法模拟,导致毒性、溶解度、结合亲和力等关键性质的预测存在较大误差,可能遗漏潜在有效药物或误判有害分子;
数据依赖度极高:CML 模型的训练需要海量高质量标注数据,而药物研发中,尤其是罕见病相关的分子数据、临床数据极度稀缺,且数据采集和标注成本高昂,严重制约模型性能;
计算复杂度爆炸:随着分子尺寸增大(如蛋白质、复杂天然产物),其可能的构型组合呈指数级增长,经典计算机即使采用优化算法,也难以在合理时间内完成模拟和筛选,例如模拟含数十个原子的小分子能量分布就需耗费数天。
1.2 QML 的核心优势:量子特性赋能研发升级
QML 将量子计算的独特优势与机器学习的数据分析能力相结合,从底层改变了数据处理和模拟的逻辑:
并行处理能力:量子比特(Qubit)突破了经典比特 “非 0 即 1” 的限制,可处于 0 和 1 的叠加态,这意味着一个量子比特能同时处理多种信息,成千上万个量子比特组成的系统,可并行探索海量分子构型,大幅提升筛选效率;
量子模拟适配性:分子本身就是天然的量子系统,QML 无需像经典模型那样进行复杂近似,可直接建模电子结构、分子轨道等量子特性,让模拟结果更贴近真实情况,预测精度显著提升;
低数据依赖潜力:量子算法的高表达能力使 QML 模型在少量标注数据下就能完成有效训练,这对于数据稀缺的药物研发场景而言,具有不可替代的价值。
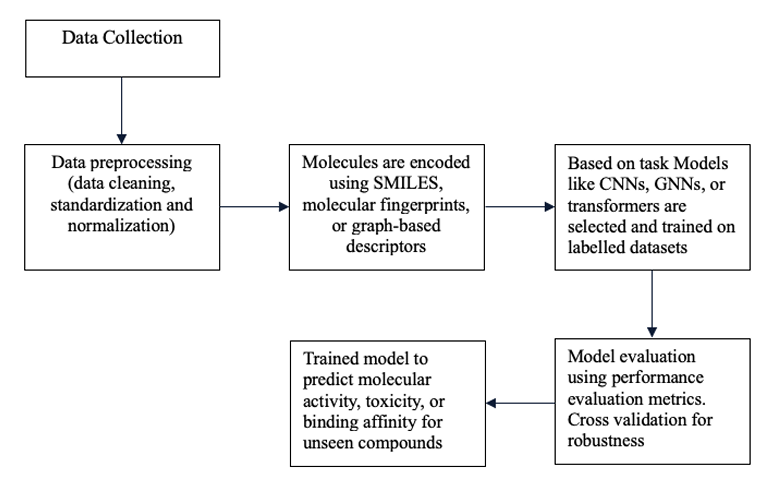
图1 经典深度学习药物发现全流程
二、QML 在药物发现的三大核心应用场景
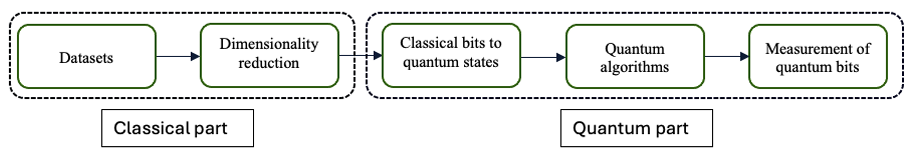
图2 混合量子 - 经典算法工作流程
QML 已深度渗透到药物研发的关键环节,在分子性质预测、药物 - 靶点相互作用分析、全新分子设计三大核心任务中展现出强劲实力:
2.1 分子性质预测:精准筛选 “潜力股”
分子的 ADME-Tox(吸收、分布、代谢、排泄、毒性)性质是药物筛选的第一道 “生死线”,只有通过这一环节的分子,才具备进一步研发的价值。QML 通过量子支持向量分类器、量子神经网络等模型,结合分子的 SMILES 字符串等表征信息,能精准预测这些关键性质:
与经典模型相比,QML 能更精准捕捉分子结构与性质之间的非线性关系,避免因近似模拟导致的误差;
针对经典量子变分模型存在的梯度消失问题,量子水库计算(QRC)等创新方法无需在量子硬件层面计算梯度,进一步提升了模型的训练稳定性和预测可靠性,为早期分子筛选提供了更精准的判断依据。
2.2 药物 - 靶点相互作用预测:锁定有效结合
药物 - 靶点相互作用(DTI)预测是判断药物分子能否与靶蛋白有效结合的核心步骤,直接决定药物的治疗效果。QML 在这一领域的应用的显著优势:
适配小数据集场景:许多疾病的靶蛋白数据稀缺,经典模型难以训练出有效模型,而 QML 凭借量子算法的高效性,在少量数据下就能实现高精度预测,尤其适用于罕见病药物研发;
混合模型优势凸显:将 3D 空间图形 CNN 等经典深度学习结构与量子电路融合的混合模型,不仅提升了结合亲和力预测的精度,还增强了模型的稳定性,为药物剂量优化、副作用评估提供了更可靠的支撑。
2.3 全新分子生成:“从头设计” 理想药物
“从头设计”(de novo)具有特定药效的分子,是药物研发的终极目标之一,也是最具挑战性的环节。经典生成模型如 GANs、VAEs 在探索庞大的化学空间时,常面临训练困难、难以覆盖关键区域等问题,而 QML 生成模型则展现出独特优势:
量子生成模型效率更高:量子 GANs、量子玻尔兹曼机(QBM)等模型能更高效地探索化学空间,避免经典模型的局部最优陷阱,有机会发现传统筛选方法遗漏的全新分子结构;
混合框架兼顾性能与可行性:结合经典深度生成模型与量子计算的混合框架,通过量子电路增强 latent 层的表达能力,能在保证分子化学稳定性的前提下,精准生成符合靶标需求的药物分子,大幅提升从头设计的效率和成功率。
三、QML 与经典机器学习:核心差异一目了然
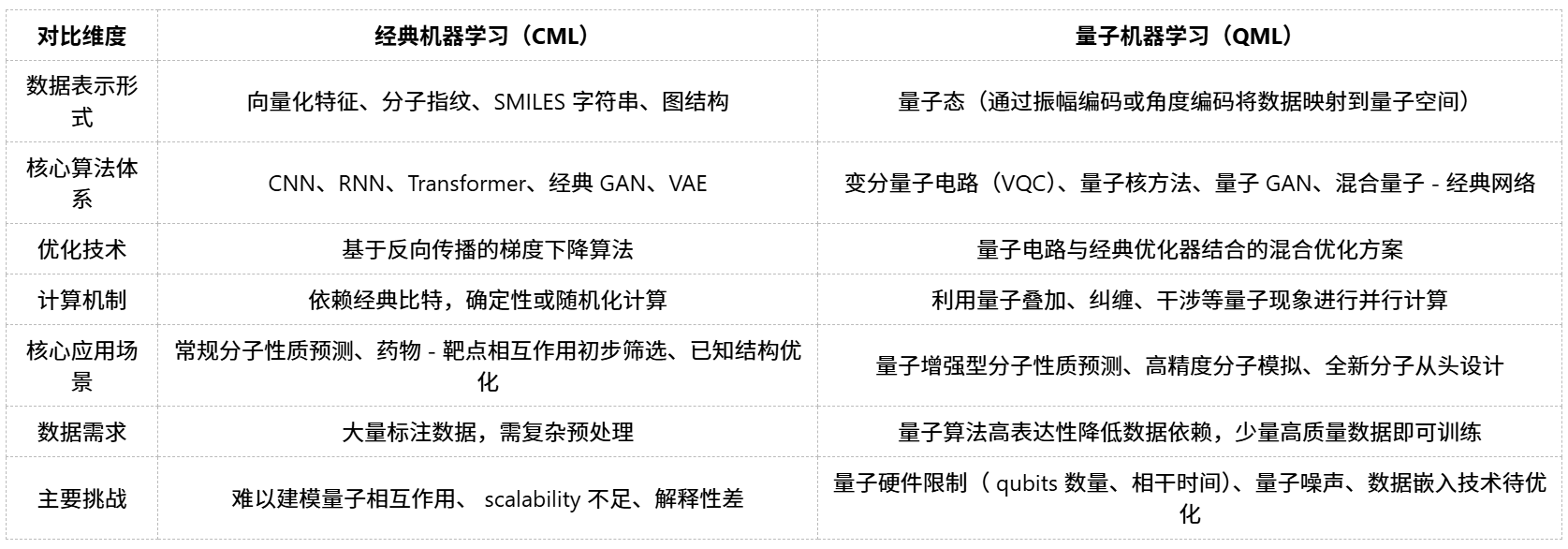
四、QML 落地药物研发:当前挑战与未来蓝图
尽管 QML 在药物发现领域展现出巨大潜力,但目前仍处于发展初期,面临一系列需要突破的挑战,同时也孕育着广阔的未来前景:
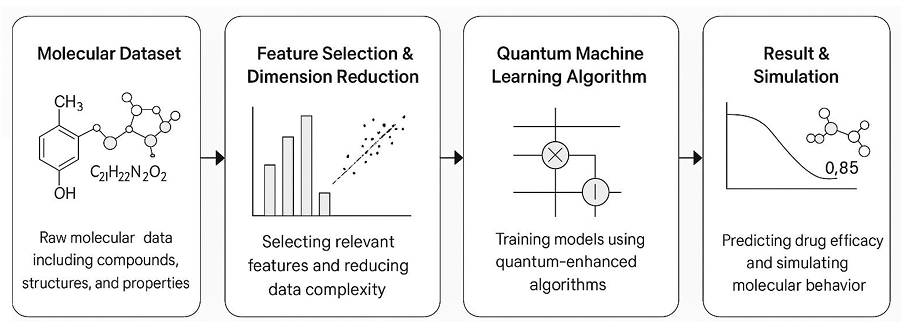
图3 量子机器学习(QML)药物发现详细流程示意图
4.1 当前核心挑战
硬件层面限制:当前主流的含噪声中等规模量子(NISQ)设备, qubits 数量有限,且相干时间短,难以支撑大型蛋白质、复杂分子的模拟需求,限制了 QML 在更复杂场景的应用;
量子噪声干扰:量子比特极易受到环境干扰产生噪声,导致计算结果出现误差,而高效的量子纠错技术仍在研发中,成为影响 QML 精度的关键因素;
数据嵌入难题:药物研发数据多为多维、异质结构,如何将这些经典数据高效嵌入量子态,同时保留关键信息,是当前 QML 算法优化的核心方向之一;
算法优化不足:部分量子算法(如变分量子本征求解器 VQE)的计算成本较高,在处理大规模分子系统时效率有待提升,需要进一步优化算法结构和执行逻辑。
4.2 未来发展方向
技术突破:研发噪声鲁棒性更强的量子算法,降低对硬件纠错能力的依赖;优化数据嵌入技术(如密度矩阵嵌入理论),提升多维分子数据的量子化效率;
数据支撑:构建公开、高质量的量子分子数据集,打破数据壁垒,降低研究门槛,促进 QML 模型的快速迭代;
应用拓展:将 QML 应用于分子动力学实时模拟、蛋白质折叠预测、自由能计算等更核心的环节,进一步覆盖药物研发全流程;
跨学科合作:加强量子计算、化学、生物学、计算机科学等领域的交叉合作,整合多学科 expertise 优化模型设计,同时开发开源的 QML 药物发现框架,推动技术落地。
五、总结:量子赋能,重塑药物研发格局
QML 的出现,不仅是技术层面的创新,更是药物研发理念的革新 —— 它首次将分子的 “量子本质” 与 “数据驱动” 高效结合,打破了经典计算机的模拟局限,为解决药物研发周期长、成本高、成功率低等痛点提供了全新路径。尽管目前仍面临硬件、算法、数据等多重挑战,但随着量子技术的不断成熟,QML 有望在未来 10-20 年内成为药物研发的核心工具。
从罕见病药物的快速研发到全新抗生素的设计,从降低研发成本到提升药物安全性,QML 正逐渐从实验室走向产业化应用,有望让药物研发不再是 “碰运气” 的漫长探索,而是精准、高效的科学设计,为人类健康事业开辟全新篇章。
论文链接:https://submissions.adroidjournals.com/index.php/ijssic/article/view/158 | 











